Immagine | Pixabay @koto_feja - Importpharma.it
Vediamo cosa sono i macrofagi, ovvero le cellule spazzine del nostro organismo e il loro collegamento con i tumori
I macrofagi sono cellule del sistema immunitario altamente specializzate che si trovano nei diversi tessuti dell’organismo, svolgendo la funzione di “pulitori del corpo umano”. Queste cellule si concentrano nelle zone in cui è richiesto eliminare residui, come batteri, prodotti derivanti dal degrado dei tessuti o cellule danneggiate. Ma cosa sono esattamente? E qual è il loro collegamento con le cellule tumorali? Vediamo insieme le risposte a queste domande.
Tutte le caratteristiche e le funzioni dei macrofagi
Nel flusso sanguigno, i macrofagi non si trovano in questa forma, ma piuttosto come precursori noti come monociti; la presenza di queste cellule nel circolo (1-6% della conta leucocitaria totale) è effimera, approssimativamente 8 ore, riflesso del periodo tra la loro generazione nel midollo osseo, la comparsa nel circolo e la definitiva migrazione nei tessuti (processo noto come diapedesi). A livello tissutale, i monociti subiscono un aumento di dimensioni, lisosomi più numerosi e si differenziano in macrofagi, alcuni dei quali restano fissi in posizioni specifiche (macrofagi residenti), mentre altri possono spostarsi tramite movimenti ameboidi (macrofagi reclutati). Diverse popolazioni di macrofagi, dal fenotipo distintivo, sono presenti in ogni organo e nelle diverse regioni di milza e linfonodi (due delle aree in cui queste cellule sono particolarmente presenti, data la necessità di eliminare numerose particelle, tossine e sostanze indesiderate).
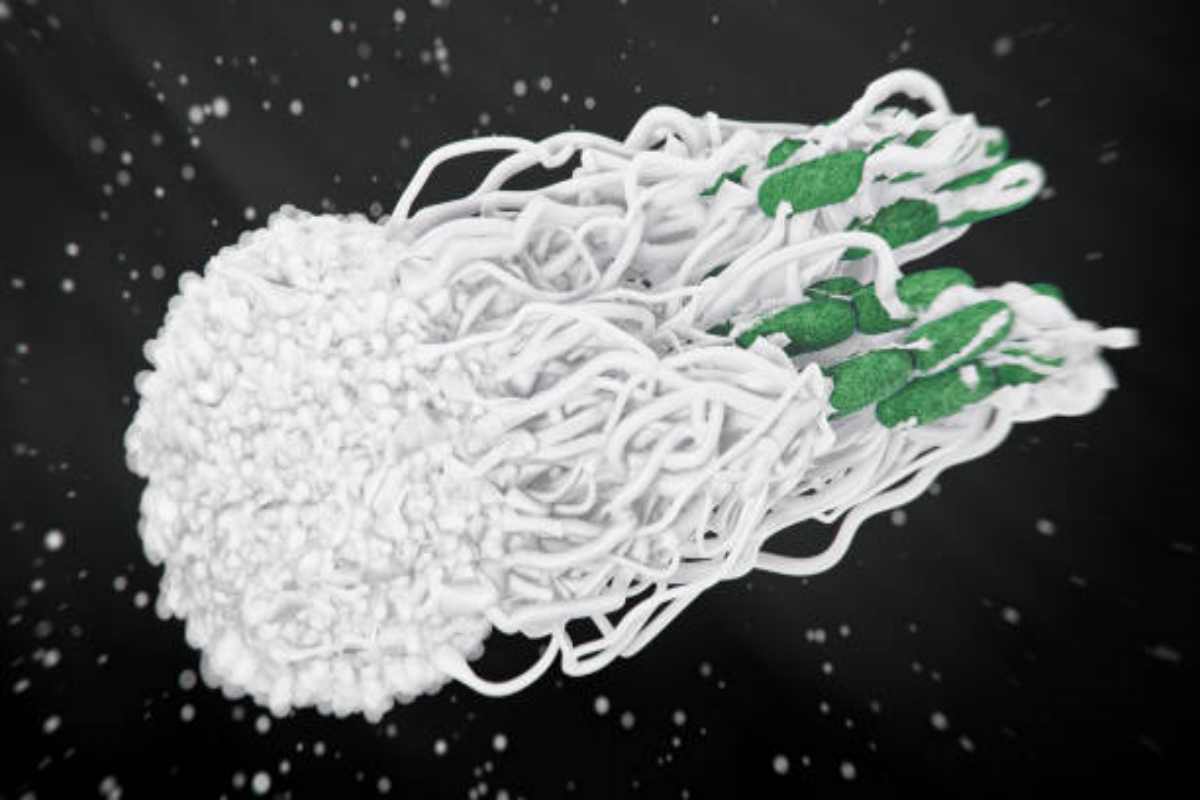
Nel corso della sua vita, un macrofago può eliminare più di 100 batteri, ma in situazioni critiche può anche liberare i tessuti da particelle più grandi, come globuli rossi invecchiati o neutrofili necrotici (questi ultimi, a differenza dei macrofagi, sono globuli bianchi più piccoli ma molto più numerosi, agendo principalmente nel circolo ematico). In generale, i macrofagi ingeriscono e digeriscono gli antigeni, cioè tutto ciò che è estraneo o riconosciuto come tale, dignitoso di attacco e neutralizzazione. Una volta digeriti, i macrofagi elaborano alcune componenti, esponendole sulla loro membrana esterna legate a recettori di superficie (proteine MHC, note come “complesso maggiore di istocompatibilità”). Questi complessi, vitali per la funzione immunitaria, agiscono come speciali “antenne” o “bandierine identificative” che segnalano alle altre cellule immunitarie il pericolo, chiedendo rinforzi. Quando svolgono questa funzione, i macrofagi vengono chiamati cellule presentanti l’antigene (APC, Antigen-Presenting Cell).
Oltre a esporre l’antigene ai linfociti, i macrofagi generano e rilasciano diversi prodotti di secrezione (tra cui alcune interleuchine e il fattore di necrosi tumorale TNF-alfa), facilitando la comunicazione tra i vari tipi di linfociti; sono, quindi, in grado di influenzare il movimento e l’attivazione di altre cellule del sistema immunitario.
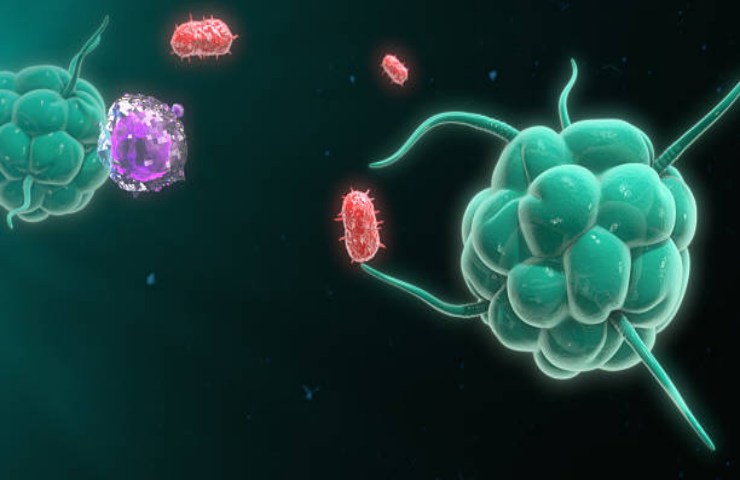
Ma come fa un macrofago a identificare una cellula come minacciosa? Altri componenti del sistema immunitario, i linfociti, sono in grado di riconoscere gli antigeni e di segnalarli come pericolosi ai macrofagi. Questi ultimi, infatti, sono intrinsecamente abili a catturare gli antigeni, riconoscendo specifiche molecole di superficie che si legano direttamente ai loro recettori di membrana specifici. In questo modo, il fagocita assorbe letteralmente e digerisce la particella estranea. Nonostante il macrofago possa riconoscere numerose particelle estranee, sia organiche che inorganiche (come il carbone e le particelle di asbesto), alcune sostanze sfuggono a questo processo di identificazione, rendendo il macrofago incapace di percepirne la pericolosità. È il caso, ad esempio, dei batteri cosiddetti capsulati, in cui una capsula polisaccaridica esterna maschera i marcatori di superficie. Altri patogeni batterici mimetizzano la loro superficie con molecole simili a quelle dei globuli bianchi, ingannando così i macrofagi. Pur eludendo l’osservazione iniziale dei macrofagi, questi antigeni sono comunque identificati dai linfociti, che producono anticorpi contro di essi. Questi anticorpi si legano alla superficie dell’antigene, come bandierine identificative, consentendo ai macrofagi di riconoscerne la pericolosità e neutralizzarli.
Dopo che il patogeno è stato convertito in nutrimento per i macrofagi, queste cellule lo legano, lo avvolgono e lo inglobano, confinandolo in vescicole chiamate fagosomi. All’interno del macrofago, i fagosomi si fondono con i lisosomi, vescicole contenenti enzimi digestivi e agenti ossidanti, come idrolasi acide e perossido d’idrogeno, che eliminano e degradano quanto inglobato. Si formano così i fagolisosomi, comunemente noti come “camere della morte”.
A parte i grandi lisosomi, i macrofagi si distinguono per le dimensioni notevolmente maggiori rispetto agli altri leucociti, per l’apparato del Golgi e il nucleo particolarmente sviluppati, e per la presenza di abbondanti filamenti acto-miosinici, conferendo al macrofago una certa capacità di movimento (migrazione nelle aree infette).
Ma in che modo i macrofagi sono collegati con i tumori? I macrofagi, le cellule “pulitrici” del nostro organismo, dopo aver “assorbito e digerito” una struttura estranea, presentano frammenti di antigene sulla loro superficie per mostrarli ai T helper, i quali, riconoscendoli, si attivano e iniziano a secernere sostanze chiamate citochine. Queste citochine assistono gli altri tipi di linfociti T nell’eliminare le cellule estranee che hanno attaccato l’organismo (attività citotossica). I macrofagi possono eliminare specifiche cellule tumorali quando sono attivati da vari fattori, compresi i fattori solubili come le linfochine (prodotte dalle cellule T) e l’interferone. Anche se i meccanismi citotossici mediati dalle cellule T sono più efficaci, i macrofagi possono, in certe circostanze, presentare gli antigeni associati al tumore alle cellule T, stimolando risposte immunitarie specifiche contro il cancro. Gli stati opposti dei macrofagi associati al tumore (TAM) includono:
- Le cellule TAM-1 (M1) facilitano l’eliminazione delle cellule Tumorali
- TAM-2 (M2) promuovono la tolleranza al tumore
M1 e M2 sono considerati come un’unica entità fino a quando non si differenziano (polarizzano) completamente in M1 e M2. La polarizzazione può variare nel tempo e dipende dalla loro posizione all’interno del tumore (zone più o meno ipossiche), dallo stadio e dal tipo di cancro, e dal trattamento precedente.
La vaccinazione sfrutta in modo brillante la capacità dell’immunità specifica di riconoscere antigeni specifici, preparandola per reagire a eventuali minacce, come agenti infettivi che esprimono l’antigene. I compartimenti immunitari cooperano per sviluppare una risposta immune efficace; ad esempio, in situazioni di pericolo, i macrofagi lavorano per promuovere l’immunità specifica, richiamando e attivando i linfociti. Tuttavia, nei tumori, questo dialogo essenziale viene distorto. I macrofagi, una volta attratti nei tessuti tumorali, vengono “riprogrammati”, perdendo le loro funzioni antitumorali e contribuendo alla crescita e alla diffusione delle cellule maligne. Questa modifica avviene nel “microambiente tumorale”, attivando circuiti molecolari che sfruttano la “plasticità funzionale dei macrofagi”. Il tumore manipola il programma genico dei macrofagi, decidendo e dirigendo le loro funzioni a suo vantaggio. Questo processo influisce sulla famiglia di complessi proteici nucleari, i fattori trascrizionali, che agiscono come interruttori molecolari per regolare le funzioni cellulari. Comprendere questi meccanismi potrebbe aprire nuove strade terapeutiche mirate.
